Ponto de Fusão e de Ebulição de uma Substância Pura
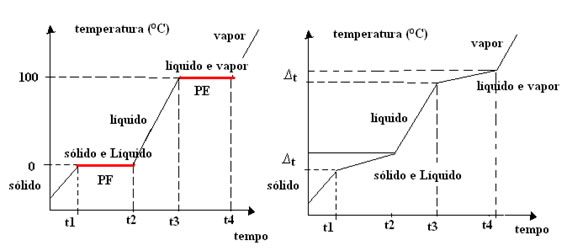
Durante o aquecimento de substâncias puras, quando se atinge o ponto de fusão ou de ebulição, a temperatura da substância deixa de aumentar, mesmo que continues a aquecê-la. Só quando toda a substância tiver sofrido a mudança de estado físico é que a temperatura volta a aumentar. Eis como varia a temperatura quando aquecemos uma amostra de água pura, desde os -100 ºC até aos 200 ºC:
Durante o arrefecimento de substâncias puras, quando se atinge o ponto de fusão ou de ebulição, a temperatura da substância deixa de diminuir. Só quando toda a substância tiver sofrido a mudança de estado físico é que a temperatura volta a diminuir. Eis como varia a temperatura quando arrefecemos uma amostra de água pura, desde os 200 ºC até aos -100 ºC:
Ponto de Fusão e de Ebulição de uma Solução Aquosa
Quando a água tem substâncias dissolvidas, inicia a fusão a temperaturas inferiores a 0 ºC. Por outro lado, inicia a ebulição a temperaturas superiores a 100 ºC. Durante a fusão ou ebulição de uma solução aquosa, a temperatura não se mantém constante. Durante o aquecimento, quando se atinge o ponto de fusão ou de ebulição, a temperatura da solução continua a aumentar, embora esse aumento seja menos acentuado. Eis como varia a temperatura quando aquecemos uma solução aquosa de cloreto de sódio, desde os -100 ºC até aos 200 ºC:
Durante o arrefecimento de uma solução aquosa, quando se atinge o ponto de fusão ou de ebulição, a temperatura da solução continua a diminuir, embora essa diminuição seja menos acentuada. Eis como varia a temperatura quando arrefecemos uma solução aquosa de cloreto de sódio, desde os 200 ºC até aos -100 ºC: